중국 진출기업, 불필요한 소송 없도록 동향 주기적 파악해야

중국의 특허법 개정으로 오는 6월1일부터 중국에서 의약품 허가특허연계제도가 시행된다. 의약품 허가특허연계제도란, 제약업체의 제네릭 의약품 시판허가 신청시 신약에 관한 타인의 특허권 침해여부를 확인하는 제도다.
25일 한국지식재산연구원에 따르면, 중국의 허가특허연계제도 시행으로 향후 중국에서 의약품 시장 선점을 위한 제약회사 간 특허 침해소송이나 무효심판 등 특허분쟁이 대폭 증가할 것으로 예상된다.
중국 개정 특허법 제76조에 따라, 의약품의 시장판매 심사평가·심사비준 과정 중에 의약품의 시장판매 허가신청인이 관련 특허권자 또는 이해관계자와, 등록 신청된 의약품과 관련된 특허권으로 인해 분쟁이 발생한 경우 관련 당사자는 인민법원에 소송을 제기할 수 있다. 또한 등록 신청된 의약품과 관련된 기술방안이 타인의 의약품 특허권 보호범위에 속하는지 여부에 대한 판결을 청구할 수 있다.
우리나라는 2007년 한미 FTA 체결에 따라 두 차례(2012년, 2015년)에 걸친 약사법 개정을 통해 2015년 3월부터 의약품 허가특허연계제도를 전면적으로 시행하고 있다. 제도 시행 초기 우리나라에서는 제약사 간의 특허소송이 급격히 증가했는데, 이는 제네릭 제약사가 특허권자의 권리행사에 대한 사전대처 및 우선판매권 취득을 위한 요건 충족 측면에서 등재 특허권에 대한 무효심판을 활발하게 제기한 결과였다.
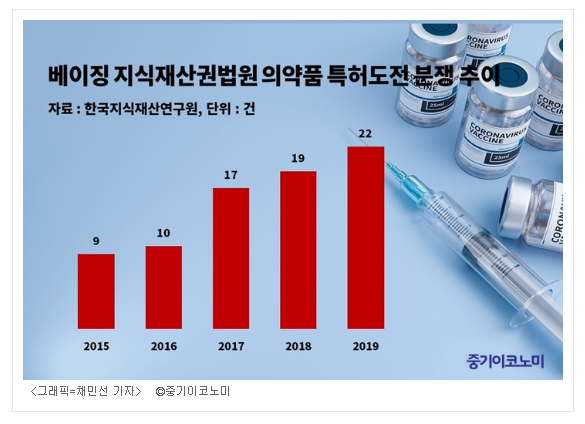
‘2019년 중국 바이오의약산업 발전 보고서’에 따르면, 최근 중국에서 의약품의 허가등록은 2017년 4836건에서 2019년 11월 현재 7619건으로 크게 증가했다. 또한 2014년 베이징 지식재산권법원 설립 이후 2020년 2월까지 동 법원에 접수된 의료특허 관련 분쟁은 702건으로, 이 중 약 251건은 의약품 특허사건이다. 의약품 특허도전(무효심판청구) 분쟁도 해마다 증가하는 추세로 2015년 9건이었던 것이 2017년 17건, 2019년 22건으로 나타났다.
한국지식재산연구원 이명희 박사는 “최근 K바이오의 중국 진출이 활발한 가운데 우리나라 바이오제약기업들이 중국의 허가특허계연계도의 시행으로 불필요한 특허소송에 휘말리지 않도록 주의가 필요하다”며, “정부도 중국내 관련 소송 동향을 주기적으로 파악하여 우리 제약산업에 제공할 필요가 있다”고 말했다. 중기이코노미 채민선 기자
<저작권자 ⓒ 중기이코노미. 무단전재 및 재배포 금지>